纤维蛋白胶的组成和作用机制
发布日期:2020/10/20 9:12:51
背景及概述[1]
纤维蛋白胶或纤维蛋白黏合剂已被许多外科医生倡导为最理想的止血剂或黏合剂,是天然的人源性产品,无组织毒性,几秒钟到几分钟内黏合,随后几天到几周被吸收,对局部组织的生长和修复有作用。纤维蛋白胶有两个主要成分,在临床使用时,两个成分被分别吸到单独的注射器内,个成分主要是纤维蛋白原以及因子ⅩⅢ和纤维结合蛋白,第二个成分为凝血酶(或牛凝血酶)和氯化钙。两种溶液混合后,凝血酶使纤维蛋白原转变为纤维蛋白单体,进一步变为凝胶,此过程中因凝血酶使因子ⅩⅢ活化,3~5min内纤维蛋白单体交链而增加凝胶的强度和黏合力,凝血酶的浓度决定了凝胶部分的形成速度。在临床大多数情况下,使用高浓度凝血酶特别利于止血,因而使用此凝血酶浓度,几秒钟内凝胶即变硬。低浓度凝血酶,这个凝固速度可能对预先黏合多孔血管移植物是有用的,纤维蛋白胶的黏合强度直接与纤维蛋白原的浓度呈正比。除了黏合和止血外,还发现这种凝胶由于纤维结合蛋白存在而促进创伤愈合,是一种外科用药,包括显微外科、神经外科、心脏外科、泌尿外科、耳鼻喉外科、妇产科等,尤其心血管外科使用最为广泛。
组成和作用机制[2]
纤维蛋白胶(FibrinGlue)又称纤维蛋白粘合剂(FibrinSealant,FS),是一种从人血浆中提取的生物制品,主要由凝血酶和纤维蛋白原等制剂组成。目前它在组织相容性、无毒性和临床有效性等方面的性能优于其他任何一种生物或人工合成的外用止血剂。
纤维蛋白胶的作用机制是模仿血液凝固的最后阶段,即在凝血酶和钙离子的作用下,纤维蛋白原(纤原)分子裂解出纤维蛋白肽A和肽B,导致纤维蛋白单体形成,同时凝血酶也激活因子,后者参与纤维蛋白的交叉联结,并使纤维蛋白形成稳定的、非脆性凝块。
不同制造商生产的纤维蛋白胶在组成成分方面有所差异,差别在于是否含抗纤溶剂———牛抑肽酶(Bovineaprotinin),这也是欧洲制品与美洲制品的主要区别,有学者认为加入抑肽酶在理论上可增加纤维蛋白凝固或粘合的持续时间。如使用不含抑肽酶的纤维蛋白胶,则生长的细胞会从基质上脱离,而当制剂中加有3000kIU/ml的抑肽酶时,则可防止细胞脱落。也有学者描述了低浓度的抑肽酶
(20kIU/ml)虽有抗纤溶作用,但很快会从纤维蛋白胶部位扩散开去;而高浓度的抑肽酶,可抑制周围组织的纤溶反应。在某些纤维蛋白溶解酶活力很高的组织部位施行手术(如:肺、肾、子宫、前列腺等),通常需要应用含抗纤溶剂的产品。大多数学者则认为没有必要加入抗纤溶剂,因为动物异体蛋白的存在可能会引发一些不良反应与风险,如过敏反应、传染性海绵状脑病等;在一些特定的部位如中耳,要求纤维蛋白胶快速分解,根本不需要抗纤溶剂的存在。
临床应用[2]
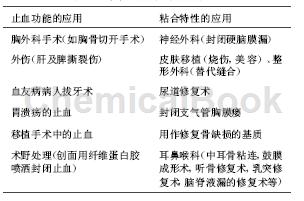
大量临床研究资料表明纤维蛋白胶能快速有效控制外科手术过程中血液的流失,尤其在控制缓慢出血,体液渗出,针线处渗血,淋巴液渗出及实质性脏器的出血等方面具有显著特点。在手术过程中将纤维蛋白胶均匀地喷在创面上,能很快在创伤表面形成一层屏障,避免坏死组织细胞内的溶蛋白酶漏出,迅速结痂止血,防止周围组织进一步受损。等到早期的创面组织已经开始了有序的生长以后,纤维蛋白胶已被人体降解吸收。纤维蛋白胶又能起到了粘合剂的作用,使分离的人体组织更容易结合在一起;对于小的创面可省去缝合步骤,在临床手术和内窥镜治疗中有极高的实用价值和广阔的应用前景,因而备受关注。
不良反应[2]
除传播病毒的可能性外,由于操作疏忽使纤维蛋白胶进入血管,从而产生血栓的可能性是存在的,但实际操作中很罕见。如在体外循环手术中使用纤维蛋白胶在理论上有一定危险性,但这种情况至今未见报道[。令人欣慰的是,在血管移植物上使用纤维蛋白胶后没有证据表明血管内血栓发生率会提高。事实上,已有很多资料表明,用纤维蛋白胶处理过的移植物不会引起血栓,并且比没有处理过的发生率要低。
使用牛凝血酶后会在人体内产生相应抗体。大多数制造商制备的牛凝血酶都混有牛凝血因子V,进入人体后可发生交叉免疫反应,所产生的免疫复合物经血循环被清除,由此可导致人凝血因子V的缺乏,并可能引起严重出血倾向。牛凝血酶引发交叉免疫反应所产生的抗体,可能会因其削弱抗凝血酶Ⅲ(AT-Ⅲ)的正常抑制作用而导致血栓形成。为此许多制造商已考虑用人凝血酶替代牛凝血酶。现已上市的三家公司产品Tisseel、BeriplastP、Biocol均使用人凝血酶制剂。
纤维蛋白胶使用是否会引起相关的粘连尚存在争议。在动物试验中局部运用或滴注纤维蛋白胶以修复实验性胸肋部损伤,最初虽观察到两组均有粘连形成,但在4-6个月后粘连近乎消散,也没有观察到创口对这些物质发生反应。采用大白兔血管阻断模型研究腹腔内粘连形成,结果显示纤维蛋白胶明显降低腹膜切口和结肠粘连。
由于纤维蛋白胶制备过程中均采用一种或几种病毒灭活处理,因此它的生物安全性是可靠的,至今尚未见使用纤维蛋白胶而被病毒感染的报道。这种潜在危险也可通过用患者自身的纤维蛋白原定制纤维蛋白胶的技术来解决。
纤维蛋白胶与药物新剂型[3]
药物新剂型比如微球、微囊、脂质体以及纳米粒等,可以使药物在原有治疗作用的基础上,实现缓释控释以及靶向给药的效果,从而提高药效,减少毒副作用,达到更好的治疗效果。以纤维蛋白胶作为载体,与微球、脂质体以及纳米粒等新剂型联合应用时,可以使药物长时间驻留在给药部位,更好的发挥药物新剂型的优势,进一步提高治疗效果,尤其适合局部抗肿瘤、神经修复以及骨愈合等情形。
1. 纤维蛋白胶与微球
微球制备工艺相对简单,制备后结构稳定,很多研究者将治疗性的生物大分子,如神经营养因子(GDNF)、骨形态生成蛋白(BMP-2)以及化学药物包裹在微球制成的给药系统中。再将药物微球包载入纤维蛋白胶,不仅可以使药物长时间滞留在给药部位,还可以避免突释效应。建立大鼠后肢神经间断模型,将纤维蛋白胶与包裹有GNDF的乳酸-羟基乙酸共聚物(PLGA)微球相混合后,递送至神经
损伤部位,观察神经修复情况。结果表明,GNDF在纤维蛋白胶-微球递送系统中能够稳定持续释放超过15d,并且与阴性对照组相比,能够显著的提高末端神经再生能力,以及神经再生后肢体运动功能恢复能力。在另一项研究中,将免疫抑制剂他克莫司包载在纤维蛋白胶-PLGA微球递送系统中,体外研究结果表明,可以通过调节处方比例来调节他克莫司的释放速度,在背根神经节(DRG)神经突扩展试验中,给药系统未改变他克莫司的药物性质,且在持续释放过程中始终保持其生物活性。纤维蛋白胶组织相容性好,黏附能力强,可以与含放疗药物的给药系统相结合用于颅内肿瘤的治疗。糖尿病患者在接受医疗器械植入后往往伴有局部感染、伤口愈合困难、排异反应强烈等问题,甚至会导致植入失败。将胰岛素包载在PLGA微球中,然后制备成胰岛素-微球-纤维蛋白胶复合物,采用大鼠糖尿病模型考察胰岛素-微球-纤维蛋白胶复合物对体内植入物的生物力学性能的影响。研究者在大鼠胫骨植入钛金属植入物,经过8周愈合后采用去除扭矩测试法(removaltorquetests,RTQ)对植入物的生物力学保留进行评价。实验结果表明,给药组的RTQ得分显著高于空白对照组,说明胰岛素-微球-纤维蛋白胶能够显著改善糖尿病大鼠体内植入物的生物力学保留性能。
2. 纤维蛋白胶与脂质体
制备脂质体-壳聚糖骨架-纤维蛋白胶复合给药系统用来递送亲水性小分子药物。用替罗非班为模型药物,制备了复合给药系统,在体外评价了其释药特征。结果显示,与不包载入纤维蛋白胶的替罗非班脂质体相比,替罗非班复合给药系统能够显著减少突释效应,并且释放得更为稳定长久。
3. 纤维蛋白胶与纳米粒
近些年对于纳米药物的研究突飞猛进,纳米药物可以提高难溶性药物的溶解度,改善制剂的稳定性,将纳米药物与纤维蛋白胶联合使用,可以在具有纳米药物原有优势的基础上,增强在局部的滞留能力,进一步提高药物疗效和安全性。
使用聚己酸内酯制成含甲基强的松龙的纳米粒,之后将其包载入纤维蛋白胶中,用来治疗急性脊髓损伤。在大鼠模型中,Karabey-Akyurek等将实验组采用局部给药的方式给予含有低剂量甲基强的松龙纳米粒的纤维蛋白胶,对照组采用系统给药的方式给予高剂量甲基强的松龙溶液,之后以3种炎症性细胞因子(白细胞介素-1β,白细胞介素-6和细胞凋亡蛋白酶-3)作为评价指标。结果表明,局部给低剂量的甲基强的松龙纳米粒-纤维蛋白胶的实验组与对照组结果无差异,说明构建的局部给药系统能够以更低的剂量达到高剂量全身给药的效果,并且能降低全身性的不良反应。
主要参考资料
[1] 内科学·卷
[2] 新型外用生物止血剂———纤维蛋白胶
[3] 纤维蛋白胶用于药物递送的研究进展
欢迎您浏览更多关于纤维蛋白胶的相关新闻资讯信息
