PH标准缓冲溶液的制备方法
发布日期:2020/10/21 8:45:43
概述[1]
PH标准缓冲溶液是一种在一定程度上可保持其pH值不变的溶液。如果向溶液中加入少量的酸或碱,或溶液中的化学反应产生了少量酸或碱,或将溶液稍加稀释,溶液的酸度能基本上稳定不变。
PH标准缓冲溶液一般是由浓度较大的弱酸及其共轭碱(弱酸及其盐或弱碱及其盐)所组成。其之所以能起缓冲作用,是因为溶液中既有大量质子供应者,又含大量质子接受者,当有少量酸或碱进入介质时,通过平衡移动能使溶液的pH值基本上保持不变,当被稀释时,由于共轭酸碱对的浓度以同样程度降低,其离解度以同样程度增大,所以溶液的pH值也可以基本上不变。每一种缓冲溶液都只具有一定的缓冲能力,如果向溶液中加入酸碱过多,缓冲能力就要减弱,甚至失去缓冲作用。缓冲剂的浓度越大,溶液中共轭酸碱的浓度比接近1:1时,缓冲溶液的缓冲能力也就越大。缓冲溶液除在分析化学中广泛应用外,在自然界、生产上和科学研究中都非常重要。
分类[1]
分析化学中用到的PH标准缓冲溶液有两类:一类是用来控制溶液酸度;另一类是用来测量溶液pH值时当标准参照物用。
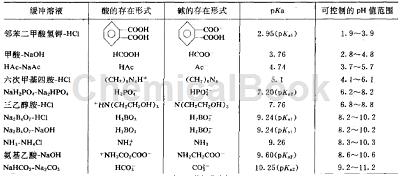
制备方法[2]
PH标准缓冲溶液配制:将配制溶液用到的药品CaCl2、NaCl、KCl、Na2SO4放置到烘箱中,在110℃下烘干1h,取出置于干燥器中冷却至室温;将TRIS置于干燥箱中,在室温条件下用五氧化二磷做脱水剂烘干。采用十万分之一精度的电子天平准确称取配制标准缓冲溶液所需的MgCl2、CaCl2、NaCl、KCl、Na2SO4、TRIS药品。称取MgCl243.8955g,用少量除氧水溶解,转移至100mL容量瓶中,用除氧水定容至100mL;称取CaCl211.0990g,用少量除氧水溶解,转移至100mL容量瓶中,用除氧水定容至100mL。
分别称取NaCl、KCl、Na2SO4各18.2333g、0.7455g、3.9771g,用少量除氧水溶解后,转移到1000mL容量瓶中,然后用移液管加入MgCl2溶液25.00mL,CaCl2溶液10.00mL,HCl溶液(4.00mol/L)25.00mL,用除氧水定容至1000mL,此为混合溶液A。分别称取NaCl、KCl、Na2SO4各24.0773g、0.7455g、3.9771g,用少量除氧水溶解后,转移到1000mL容量瓶中,然后用移液管加入MgCl2溶液25.00mL,CaCl2溶液10.00mL,用除氧水定容至1000mL,此为混合溶液B。称取TRIS1.2114g,转移到1000mL聚乙烯瓶中,然后用移液管加入50.00mL混合溶液A,再加混合溶液B在电子天平上称重至1000.00g。此溶液即为pH标准缓冲溶液。
主要参考资料
[1] 中国成人教育百科全书·化学·化工
[2] CN201510043251.2一种海水pH标准缓冲溶液的配制方法
欢迎您浏览更多关于PH标准缓冲溶液的相关新闻资讯信息

