工业硫酸的制备方法
发布日期:2020/10/24 7:56:57
概述
工业硫酸是泛指SO3与H2O以任何分子比结合的物质,不同分子比组成各种不同浓度的硫酸,主要分为浓硫酸 、稀硫酸、发烟硫酸、液体三氧化硫、蓄电池硫酸等,也生产高浓度发烟硫酸、液体二氧化硫、亚硫酸铵等产品。工业硫酸广泛用于各个工业部门,主要有化肥工业、冶金工业、石油工业、机械工业、医药工业、洗涤剂的生产、军事工业、原子能工业和航天工业等。还用于生产染料、农药、化学纤维、塑料、涂料,以及各种基本有机和无机化工产品。
理化性质【1】
工业硫酸是一种油状的液体,一般看起来是无色透明状的,硫酸的密度比水的密度大,溶于水是放出大量的热;有强烈的腐蚀性和脱水性。主要分为浓硫酸 、稀硫酸、发烟硫酸、液体三氧化硫、蓄电池硫酸等,也生产高浓度发烟硫酸、液体二氧化硫、亚硫酸铵等产品。
工业硫酸分为浓硫酸和发烟硫酸。表1为浓硫酸的技术要求,表2为发烟硫酸的技术要求。
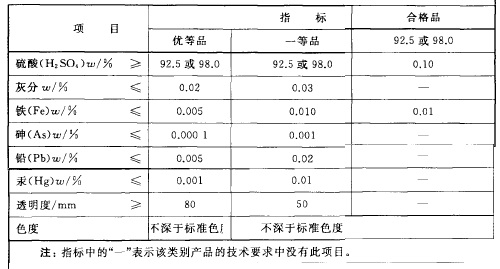
表1为浓硫酸的技术要求
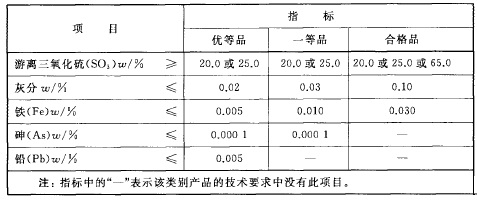
表2为发烟硫酸的技术要求
制备方法【2】
1.先将硫黄或黄铁矿在空气中燃烧或焙烧,以得到二氧化硫气体。
将二氧化硫氧化为三氧化硫是生产硫酸的关键,其反应为:2SO2+O2→2SO3
这个反应在室温和没有催化剂存在时,实际上不能进行。
根据二氧化硫转化成三氧化硫途径的不同,制造硫酸的方法可分为接触法和硝化法。
(1)接触法是用负载在硅藻土上的含氧化钾或硫酸钾(助催剂)的五氧化二钒V2O5作催化剂,将二氧化硫转化成三氧化硫。
(2)硝化法是用氮的氧化物作递氧剂,把二氧化硫氧化成三氧化硫:SO2+N2O3+H2O→H2SO4+2NO
根据所采用设备的不同,硝化法又分为铅室法和塔式法,现在铅室法已被淘汰;塔式法生产的硫酸浓度只有76%;而接触法可以生产浓度98%以上的硫酸;采用最多。
主要方程式:
4FeS2+11O2=2Fe2O3+8SO2
2SO2+O2=2SO3
SO3+H2O=H2SO4
2.硫化铁经粉碎后,进入沸腾炉焙烧,产生的二氧化硫气体,经过降温,除尘,干燥(净化),进入转化器,经催化剂作用生成三氧化硫(转化),再经浓硫酸吸收后加水。
3.将硫先转化为SO2,然后采用活性较高的催化剂再与O2反应转化成SO3。转化反应后气体换热至一定温度进入硫酸冷凝器,反应后气体中SO3与H2O在此冷却直接生成硫酸。因此,冷凝器是该工艺的关键设备,也是其关键技术所在。该设备采用了合理的换热方法和先进的酸雾控制方法,可保证气体中多余的水可以随尾气排出,且其中的酸雾达到环保标准,冷凝液为工业98%硫酸。
过程气进出酸冷却器的示意图见图1。
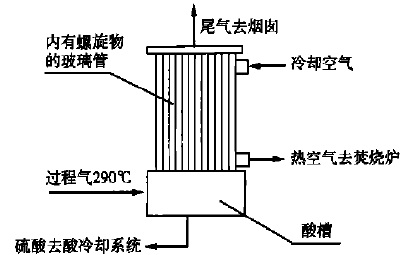
图1为硫酸冷凝器示意图
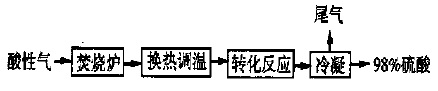
图2为WSA工艺流程
工业硫酸中硫酸的含量测定
以甲基红一次甲基蓝为指示剂,用氢氧化钠标准滴定溶液中和滴定以测得硫酸含量.
试剂和材料:
氢氧化钠标准滴定溶液:c(NaOH)=0.5mol/L, 甲基红一次甲基蓝混合指示剂。
试料溶液的制备 :
浓硫酸:
用已称量的带磨口盖的小称量瓶,称取约0.7g试样(精确至0.0001g),小心移入盛有50ml水的250 ml锥形瓶中,冷却至室温,备用。
滴定
于试液中,加2-3滴混合指示剂,用氢氧化钠标准滴定溶液滴定至溶液呈灰绿色为终点。
分析结果的表述
浓硫酸
工业硫酸中硫酸的质量分数*(%)按式(1)计算:
w1=100*[(v/1000)cM]/m (1) 式中:
v一滴定耗用的氢氧化钠标准滴定溶液的体积的数值,单位为毫升
c一氢氧化钠标准滴定溶液的实际浓度的数值,单位为摩尔每升
m一试料的质量的数值,单位为克(9);
M一硫酸的摩尔质量的数值,单位为克每摩尔(g/mol( M=49.04)
取平行测定结果的算术平均值为测定结果.
用途
硫酸是一种重要的化工原料,用途十分广泛,除用于化学工业外,还非常广泛应用于肥料、非碱性清洁剂、护肤品、油漆添加剂与炸药的制造等方面,将一定比例的三氧化硫和水混合可制得硫酸。
工业硫酸广泛用于各个工业部门,主要有化肥工业、冶金工业、石油工业、机械工业、医药工业、洗涤剂的生产、军事工业、原子能工业和航天工业等。还用于生产染料、农药、化学纤维、塑料、涂料,以及各种基本有机和无机化工产品。
危害
硫酸对人体的危害大致有三个途径——皮肤、消化器官和呼吸器官,而且危害性又分急性和慢性两种。
1、急性:人体一接触到浓硫酸,便即遭到烧伤,如果进入眼内,会使眼睛失明喝入硫酸会使内部器官严重损害或死亡。如果吸入大量热硫酸蒸气或发烟硫酸放出的浓蒸气,就会损害上呼吸道以及肺部组织,严重失去知觉。人体对这种蒸气的敏感性因人而异。
2、慢性:与硫酸接触会引起皮肤炎症,经常吸入硫酸蒸气或酸雾会引起呼吸道或支气管炎,长期吸入硫酸蒸气会引起牙齿的酸蚀症,先是失去珐琅质的光泽,继而露出象牙质,造成缺损,表面变黑。
处理方法
1.中和处理法
一般采用石灰、电石渣或烧碱对其进行中和处理,使pH值达到国家排放标准后排放。
中和法简便易行,但管理繁琐不易控制,废酸处理量受到限制,而且酸洗废液中的硫酸、FeSO4等资源没有得到有效利用。当钢铁企业酸洗废液的处理单位,与其他企业的废碱液处理单位距离较近时,可考虑利用酸碱废液相互中和,达到以“废”治“废”的目的。其缺点是当废酸量和浓度变化较大时,处理效果往往难于保证,需增设调节池或补充中和剂。
2.再生循环处理
在酸洗过程中,酸洗液中的硫酸与铁及铁的氧化物作用,生成硫酸亚铁,通过回收酸洗废液中硫酸亚铁或铁,同时补充硫酸可使酸洗废液再生。
(1)结晶法
结晶回收硫酸亚铁通常有3种方法:
①将酸洗废液冷却至-5~-10℃,大部分硫酸亚铁以FeSO4·7H2O晶体形式析出;
②酸洗废液经加热浓缩后,冷却至常温(20~25℃),硫酸亚铁以FeSO4·7H2O晶体析出;
③在酸洗废液中加入硫酸用以盐析硫酸亚铁,析出FeSO4·7H2O晶体。
降低回收硫酸亚铁成本和提高效率,采用硫酸盐析和适当降温相结合的办法是经济有效的。 结晶法具有工艺流程短、设备较简单、劳动定员少、运行费用低和易操作、无二次污染等优点。
(2)纳滤膜分离
该技术主要是利用纳滤膜对硫酸和硫酸亚铁的截留率不同,在压力的作用下,将大分子水合硫酸亚铁截留在膜的一侧,而让小分子的硫酸透过膜,实现两者的分离,然后对浓缩母液进行降温处理,使水合硫酸亚铁形成结晶析出。纳滤膜分离技术具有膜体耐热、耐酸碱性能好、操作压力低、集浓缩与透析为一体等特点。
纳滤膜分离法只有在酸洗废液产量比较大的场合下使用,才具有一定的经济性。这主要是因为纳滤膜分离法需要较高的设备投入,在运行过程中也有较高的能耗,只有达到一定的处理规模后,才可以实现收支平衡。
(3)电渗析法
电渗析法回收酸的关键在于离子交换膜的选用,一般的阴离子交换膜,H+容易透过,电流效率比较低,因此应采用H+难透过性阴离子膜,以提高电流效率;另外,从含有金属离子的酸废液中回收酸时,金属离子也会透过阳离子交换膜,因此选用阳离子交换膜时可选用一价离子交换膜,以进一步提高回收酸的纯度。
电渗析法也可以回收酸洗废液中的硫酸,并且提取其中的铁。该法的优点是设备简单,回收效率高;缺点是耗电量太高。
(4)铁屑法
该法先将硫酸废液与铁屑置于一个反应槽中充分反应,再将溶液加热到100℃,反应2h,加热浓缩后自然冷却,使硫酸亚铁结晶析出,最后由离心机脱水烘干。
铁屑法可以从酸洗废水中回收低、中、高三级硫酸亚铁,供工农业、医药、化学试剂用。具有简单易操作、投资少、费用低等优点,但只能回收硫酸亚铁,不能回收硫酸,处理能力小,残液需要再处理;产品质量差、生产周期长,适用于废液排放量不大,Fe2+含量较高的中小钢铁企业硫酸酸洗废水的处理。
(5)生物法
通常的氧化酸洗废液法都是在pH较高的条件下进行的。国外研究结果表明,可以利用微生物硫细杆菌氧化二价铁盐,然后再水解生成黄铵铁钒、FeOHSO4和α-Fe2O3。该生物氧化法的一个优势就是可以在很低的pH下进行,通常可低至pH=1.4~1.5。该方法需要在NH4+存在的条件下才能顺利进行。
处理过的液体中,剩余的铁离子的质量浓度低至0.2g/L,而硫酸的浓度已高于原始酸洗用液(0.3mol/L),所以可以直接重新回到酸洗生产线,循环利用。
(6)完全回收法—鲁兹纳法
废酸液经减压加热蒸发浓缩,其浆液送入反应器与HC1气体按下式反应:FeSO4+2HC1→H2SO4+FeCl2↓。由于FeCl2在浓硫酸液中不溶解而结晶沉淀,这样可使H2SO4和铁分离。因而用于酸洗的H2SO4可全部返回到酸洗工序再利用,而FeCl2结晶则用于制取Fe2O3粉。改进了的工艺是将FeCl2溶液直接喷射到加热600℃以上的炉窑内,Fe2O3粉从炉底排出,HCl气体返回到反应器中循环使用。使用该法生产的α-Fe2O3粉纯度可达99.3%,是铁氧体磁性材料的主要原料。
主要参考资料
[1]中华人民共和国国家标准 工业硫酸GB/T 534-2014.
[2]蒋文军.炼油厂酸性气直接制取工业硫酸技术[J].石油炼制与化工,2001(12):57-59.
欢迎您浏览更多关于工业硫酸的相关新闻资讯信息
