人CD26分子(CD26)ELISA试剂盒
发布日期:2020/4/12 10:27:55
背景[1-6]
人CD26分子(CD26)ELISA试剂盒是利用酶联免疫的方法特异性检测人CD26分子的ELISA试剂盒。
工作原理:人CD26分子(CD26)ELISA试剂盒采用人CD26分子抗原与人CD26分子抗体的特异反应将待测物与酶连接,然后通过酶与底物产生颜色反应,用于定量测定。测定的对象可以是抗体也可以是抗原。
在这种测定方法中有3种必要的试剂:①固相的抗原或抗体(免疫吸附剂)②酶标记的抗原或抗体(标记物)③酶作用的底物(显色剂)测量时,抗原(抗体)先结合在固相载体上,但仍保留其免疫活性,然后加一种抗体(抗原)与酶结合成的偶联物(标记物),此偶联物仍保留其原免疫活性与酶活性,当偶联物与固相载体上的抗原(抗体)反应结合后,再加上酶的相应底物,即起催化水解或氧化还原反应而呈颜色。
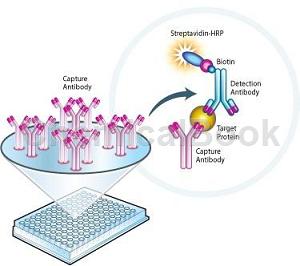
其所生成的颜色深浅与欲测的抗原(抗体)含量成正比。这种有色产物可用肉眼、光学显微镜、电子显微镜观察,也可以用分光光度计(酶标仪)加以测定。其方法简单,方便迅速,特异性强。CD26/DPPⅣ分子是一种高度糖基化的Ⅱ型跨膜蛋白,由两个同源亚单位组成,通过N末端亲水区结合在细胞膜上。人CD26/DPPⅣ基因定位于2号染色体长臂24区,约90kb,含26个外显子,在上游非编码区没有TATA盒或CAAT盒,GC丰富区域含有转录因子结合位点,肝细胞核因子能够激活转录。
CD26/DPPⅣ由766个氨基酸残基组成,分子量约ll0KD,胞内肽链极短,仅有6个高度保守的氨基酸序列,跨膜区含22个氨基酸,胞膜外段由738个氨基酸组成,可分为三个结构域:①N末端糖基化区:与跨膜区相连的20个氨基酸形成可弯曲的“茎”区,其后的区域含9个糖基化位点。②富含半胱氨酸区:③C末端催化区:CD26/DPPⅣ属于丝氨酸蛋白酶家族,此家族成员催化部位具有相似的氨基酸序列“Gly-Xaa-Ser-Xaa-GIv”。CD26/DPPⅣ第628-632位氨基酸“Gly-Trp-Ser-Try-Glv”为其催化序列,推测Ser-630为催化残基。CD26/DPPⅣ蛋白有很多生物学功能,在刺激T细胞活化、抑制前列腺癌细胞恶化、抗HIV感染等方面都发挥重要作用。它又是一种蛋白水解酶,能降解肽链N末端第二个残基上的脯氨酸或甘氨酸,产生N端二肽,故称二肽基肽酶。
应用[7][8]
人CD26分子(CD26)ELISA试剂盒可用于靶向CD26/DPPIV动员骨髓来源内皮祖细胞抑制脉络膜新生血管的研究:
骨髓来源的内皮祖细胞(endothelial progenitor cells,EPCs)可能代表一个重要的内源性修复途径。体内动员和扩增骨髓来源的EPCs能对组织修复提供充足的自体细胞,因而可能解决目前细胞治疗的瓶颈问题。基质细胞衍生因子(stromal cell-derivedfactor1α,SDF-1α)及其受体CXCR4的相互作用是调控EPCs动员的关键。最近的发现提示肽酶CD26(dipeptidyl peptidase IV,DPP IV)能降解和失活骨髓内SDF-1α,最终导致阻断SDF-1/CXCR4axis,是EPCs动员一个重要的调控机制。
而且,血管紧张素转换酶(angiotensin-converting enzyme,ACE)抑制剂能调控CD26/DPP IV从骨髓动员EPCs。尽管骨髓来源的EPCs参与了CNV的形成,但是否诱导体内EPCs动员对CNV是有益的仍然未被充分确定。EPCs能否在CNV损伤区域发挥保护作用还需要进一步被揭示。目的和内容本研究的目的是探讨调控CD26/DPP IV系统(CD26/DPP IVsystem)增加体内EPCs动员在CNV形成中的作用。确定是否在激光诱导的CNV,EPCs内源性的损伤修复机制和星形胶质细胞相关。
酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)SDF-1水平:激光诱导CNV后3、7、14天,全血离心收集血浆,同时来自股骨的骨髓上清被提取。ELISA检测血浆和骨髓上清的SDF-1α浓度。CD26/DPP IV system通过增加骨髓内蛋白水解SDF-1的活动,能负向调节SDF-1/CXCR4axis,引起循环血中SDF-1水平增加,逆转骨髓和外周血的SDF-1浓度梯度,引起EPCs从骨髓动员到外周循环。
ACEI调控CD26/DPP IV system动员EPCs可能代表一个重要的内源性修复途径。这一研究结果不但为体内扩增骨髓来源EPCs治疗眼新生血管提供了新奇的靶向,而且为BMCs细胞治疗眼微血管疾病转入临床应用提供新的思路。目前和未来的治疗应靶向干预CNV发展的病程。相对与抗血管生成的治疗,EPCs可能通过促进血管修复和再生,探索一个新奇的治疗途径,这可能被认为是理想的治疗。
参考文献
[1]EPCs and pathological angiogenesis:When good cells go bad[J].Sergio Li Calzi,Matthew B.Neu,Lynn C.Shaw,Jennifer L.Kielczewski,Nicanor I.Moldovan,Maria B.Grant.Microvascular Research.2010(3)
[2]Regulation of Bone Marrow–Derived Vascular Progenitor Cell Mobilization and Maintenance[J].Stefanie Dimmeler.Arteriosclerosis,Thrombosis,and Vascular Biology.2010(6)
[3]Intravitreal autologous bone‐marrow‐derived mononuclear cell transplantation[J].Jost B.Jonas,MathiasWitzens‐Harig,LubomirArseniev,Anthony D.Ho.Acta Ophthalmologica.2010(4)
[4]Anti-VEGF Therapies and Blood Pressure:More Than Meets the Eye[J].Frank Enseleit,Stephan Michels,Frank Ruschitzka.Current Hypertension Reports.2010(1)
[5]Stimulation of endothelial progenitor cells:a new putative effect of several cardiovascular drugs[J].European Journal of Clinical Pharmacology.2010(3)
[6]Differential Mobilization of Subsets of Progenitor Cells from the Bone Marrow[J].Simon C.Pitchford,Rebecca C.Furze,Carla P.Jones,Antje M.Wengner,Sara M.Rankin.Cell Stem Cell.2009(1)
[7]New agents for mobilizing peripheral blood stem cells[J].Hildegard T.Greinix,Nina Worel.Transfusion and Apheresis Science.2009(1)
[8]李红.靶向CD26/DPPIV动员骨髓来源内皮祖细胞抑制脉络膜新生血管的研究[D].第四军医大学,2011.
欢迎您浏览更多关于人CD26分子(CD26)ELISA试剂盒的相关新闻资讯信息
