HSP90抗体
发布日期:2020/10/25 9:01:50
背景[1][2][3]
HSP90抗体(热休克蛋白90抗体)是热休克蛋白家族分类的一种。热休克蛋白是一类在原核和真核生物中都存在的一种蛋白,具有高度的保守性。根据同源程度以及分子量的大小,热休克蛋白可分为HSP110、HSP90、HSP70、HSP60、HSP40小分子HSP及泛素等。其中,HSP90抗体是热休克蛋白家族中重要的一族,在应激时呈高表达,是不少调节蛋白和结构蛋白活化的伴侣分子,参与蛋白的运输、解聚以及保护细胞免受环境压力。在机体的抗感染免疫、肿瘤免疫及自身免疫反应中发挥重要的作用。
最初,Eguchi等最先对系统性红斑狼疮患者外周血单个核细胞中热休克蛋白水平的检测发现系统性红斑狼疮患者外周血单个核细胞中HSP90抗体增高。随着研究的深入,2001年Ripley等研究表明在系统性红斑狼疮中HSP90抗体的增高是由HSP90ß 基因转录增强所致。Minota等研究发现大约50%的系统性红斑狼疮患者中有抗HSP90抗体的表达。
Conroy等研究也发现分别有26%和35%的系统性红斑狼疮患者中存在IgM和IgG型抗HSP90抗体,并且发现抗体增高更可能发生在有肾脏损害和低C3水平的患者。而在正常人群或类风湿性关节炎及硬皮病的患者中没有发现这种抗体。大量的研究已经表明HSP90抗体的过度表达可能在系统性红斑狼疮病因学及发病机制中发挥一定的作用。此外,近年来,HSP90抗体被发现存在于多发性硬化解放军医学院博士学位论文患者的脑脊液中,这也引起了学者们的关注。
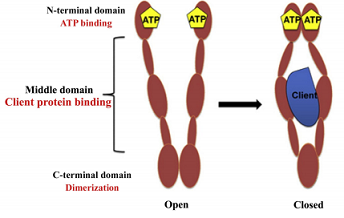
图1 HSP90抗体的结构示意图
HSP90单体包括N端、中间区域和C端3个结构域(图1)
,每个区域的功能各不相同,无 ATP结合时 HSP90抗体主要以“V”型开放构象存在。N端结 构 域 为 二 聚 体 结 构, 包 含 ATP 结 合 位 点。HSP90抗体与辅助分子伴侣共同调节 ATP 的水解过程,促使HSP90抗体分子伴侣循环开始,为该过程提供能量。中间区域(M)是底物蛋白和辅助分子伴侣的结合区域。
连接N端结构域和中间区域的是一段构象易变且带电的连接体,由于其结构不稳定给HSP90抗体全长结构的具体解析带来了很大困难。当HSP90抗体的中间区域催化环变为开放的激活状态时,HSP90抗体才具有 ATP 酶的活性。 中间区域的环状结构含有一个保守的精氨酸残基,其与ATP 的 γ-磷酸根相互作用,促进HSP90抗体调节的ATP水解供能。C端结构域是另外一个辅助分子伴侣的结合区域,负责 HSP90抗体的二聚化。
C末端具有MEEVD保守序列,该序列可与含TPR(Tetratricopeptide repeat)结构的辅助分子伴侣进行相互作用。当底物蛋白结合到中间区域后,HSP90抗体通过与辅助分子伴侣相互作用和ATP的水解放能共同调节HSP90抗体的N端构象重排,最终 HSP90抗体的构象转变为“关闭”状态,此时HSP90才可以行使其分子伴侣的功能。
HSP90抗体的作用机理及生物学作用[1][2]
HSP90抗体是一种分子伴侣。分子伴侣在发挥作用时的步是识别靶蛋白,现在人们对这个问题的了解还不多。比较明确的认识是分子伴侣只识别非天然的结构,而不识别天然的结构。推测分子伴侣可能与蛋白的疏水表面相结合,但在天然分子中,疏水残基往往位于分子的内部。在蛋白去折叠或在新生肽链的折叠过程中,疏水表面可能会暂时暴露,这样,分子伴侣便可以与之相结合了。
分子伴侣是如何识别非天然结构还不清楚。第二步是分子伴侣与靶蛋白结合形成复合物。不同的分子伴侣与不同的靶蛋白结合的亲和力是不同的。不同的分子伴侣的释放机制也不相同。Schwartz和Mizukami认为,HSP90抗体与所结合的蛋白质之间的相互作用依赖于HSP90抗体一般结构特征。人类的HSP90抗体存在于细胞内,其功能涉及到蛋白质高级结构的组装和解体、结合不同的细胞蛋白质和调节蛋白质的活性等。
HSP90抗体可与激素受体结合成复合物,这些激素受体包括雌激素、孕酮、糖皮质激素受体。HSP90抗体与受体结合后,可阻止受体与核DNA结合,使受体处于非活性状态,从而避免细胞早熟和无意义转录。HSP90抗体尚可与细胞内酪氨酸激酶、肌动蛋白和微管蛋白结合,使其稳定在一种失活或未装配状态,从而参与细胞最基本的代谢活动。
对于HSP90抗体的作用机理还不很清楚,特别在HSP90抗体是否是ATP依赖型的问题上存在着争论。但是,最近Obermatm等人的工作表明,HSP90抗体是ATP依赖型的分子伴侣,参与细胞调控蛋白的折叠和应激变性多肽的重新折叠.在生理学上HSP90抗体可以与许多细胞中的蛋白质相结合,在达到适当的细胞内位置或接受到正确的活动信号时,才会被激活。故HSP90抗体是影响基质蛋白质成熟的关键因子。
主要参考资料
[1] 朱里. HSP90、抗HSP90抗体及IL-6、IL-10在SLE中表达及相关性的实验研究[D].华中科技大学,2006.
[2] 陈翔. Ms-ON与NMO-ON临床特点及脑脊液中HSP90β抗体的差异性研究[D].解放军医学院 2015.
欢迎您浏览更多关于HSP90抗体的相关新闻资讯信息
