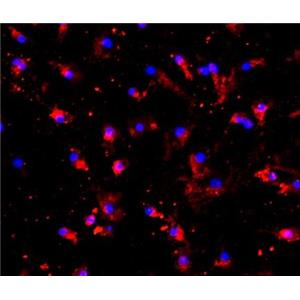
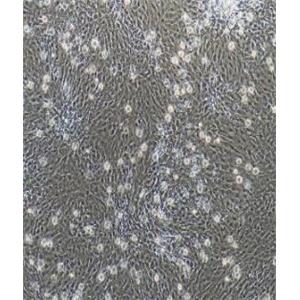
PMVEC(大鼠肺微血管内皮细胞)的应用
发布日期:2024/2/27 8:56:18
背景[1-3]
PMVEC(大鼠肺微血管内皮细胞)是一种用于科研实验的细胞类型,具有贴壁生长的特性,形态为内皮细胞样,短梭形。这种细胞来源于大鼠的肺微血管,通常用于研究肺部的生理和病理过程,如血管通透性、炎症反应、气体交换等。
在实验室中,PMVEC(大鼠肺微血管内皮细胞)可以通过细胞培养的方法进行扩增和传代。细胞培养需要特定的培养基和条件,以保证细胞的正常生长和繁殖。复苏细胞时,通常将冻存的细胞在37℃水浴中迅速解冻,并与培养基混合均匀,然后进行离心、洗涤和重新悬浮,最后加入培养瓶中培养。
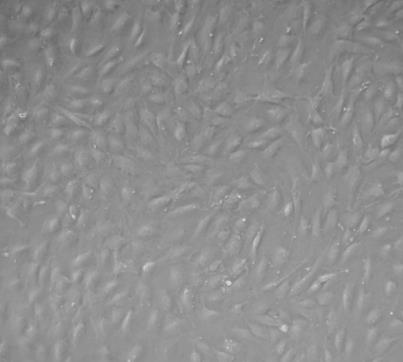
PMVEC(大鼠肺微血管内皮细胞)
PMVEC(大鼠肺微血管内皮细胞)的规格通常以细胞数量来表示,如每瓶或每管包含多少细胞。价格则因品牌、质量和数量等因素而异。在购买PMVEC时,需要注意选择正规渠道和有质量保证的产品,以确保实验结果的准确性和可靠性。
PMVEC(大鼠肺微血管内皮细胞)培养操作
1)复苏PMVEC(大鼠肺微血管内皮细胞):以下细胞培养冻存处理仅供参考,具体操作步骤以随货产品说明书为主。
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻,加4 mL培养基混合均匀。在1000 rpm条件下离心3 min,弃去上清液,加1-2 mL培养基后吹匀。然后将所有细胞悬液加入含适量培养基的培养瓶中培养过夜(或将细胞悬液加入10 cm皿中,加入约8 mL培养基,培养过夜)。第二天换液并检查细胞密度。
2)PMVEC(大鼠肺微血管内皮细胞)传代:如果细胞密度达80%-90%,即可进行传代培养。
a、弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
b、加1 mL消化液(0.25%Trypsin-0.53mM EDTA)于培养瓶中,使消化液浸润所有细胞,弃去消化液,将培养瓶置于37℃培养箱中消化1 min,然后在显微镜下观察细胞消化情况,若细胞大部分变圆并脱落,迅速拿回操作台,轻敲几下培养瓶后加少量培养基终止消化。
c、按6-8 mL/瓶补加培养基,轻轻打匀后装入无菌离心管中,1000 rpm离心4 min,弃去上清液,补加1-2 mL培养液后吹匀。
d、将细胞悬液按1:2比例分到新的含8 mL培养基的新皿中或者瓶中,置于培养箱中培养。
3)PMVEC(大鼠肺微血管内皮细胞)冻存:待细胞生长状态良好时,可进行细胞冻存。下面T25瓶为例;
a、收集细胞及细胞培养液,装入无菌离心管中,1000 rpm条件下离心4 min,弃去上清液,用PBS清洗一遍,弃尽PBS,进行细胞计数。
b、根据细胞数量加入无血清细胞冻存液,使细胞密度5×106~1×107/mL,轻轻混匀,每支冻存管冻存1mL细胞悬液,注意冻存管做好标识。
c、将冻存管放入-80℃冰箱,24 h后转入液氮灌储存。记录冻存管位置以便下次拿取。
应用[4-5]
PMVEC(大鼠肺微血管内皮细胞)可以用于肝细胞来源的miR-194激活PMVEC促进血管生成在肝肺综合征中的作用及机制
选择果蝇卵室发育过程中发生群体细胞迁移的边界细胞团作为研究对象,开展相关研究,以期发现其中的一些共性,更好的阐明肝肺综合征血管新生过程的具体机制。
研究方法:1.构建HPS大鼠模型,提取并鉴定血清外泌体,观察PMVEC(大鼠肺微血管内皮细胞)对其的吸收情况构建运用胆总管结扎术(CBDL)诱导的HPS大鼠模型,5周后进行血气、肝功、血流动力学测定以及肝肺组织病理切片分析,取假手术组和HPS组大鼠外周动脉血血清运用差速离心法提取外泌体,运用Western blot、TEM和NTA法鉴定外泌体,再用BCA测定外泌体浓度变化。最后,运用PKH67标记外泌体,与PMVEC(大鼠肺微血管内皮细胞)共培养,观察对外泌体的吸收情况。
2. 观察血清外泌体对PMVEC(大鼠肺微血管内皮细胞)增殖、迁移及成管的影响将血清外泌体与PMVEC(大鼠肺微血管内皮细胞)共培养,通过流式细胞术分析细胞周期及增殖情况;运用Transwell小室实验和划痕试验观察PMVEC(大鼠肺微血管内皮细胞)的迁移情况;采用Matrial胶体外管腔形成法观察成管能力的变化。
3. 利用miRNA生物芯片筛查外泌体miRNA差异表达谱,并进行qRT-PCR验证对大鼠外周血血清外泌体进行miRNA生物芯片筛查,得到差异表达的miRNA,运用qRT-PCR进行验证。
4. 观察miR-194对PMVEC(大鼠肺微血管内皮细胞)增殖、迁移及成管的影响将miR-194激动剂和抑制剂转染PMVEC(大鼠肺微血管内皮细胞),通过流式细胞术分析细胞周期及增殖情况;运用Transwell小室实验和划痕试验观察PMVEC(大鼠肺微血管内皮细胞)的迁移情况;采用Matrial胶体外管腔形成法观察成管能力的变化。
5. 生物信息学分析并验证潜在的miR-194靶基因运用Targetscan数据库预测miR-194的靶基因,运用Amigo数据库搜集负调控血管生成的基因,取两组数据的交集,得到miR-194潜在的调控血管生成的靶基因,运用双荧光素酶检测系统进行验证。
6. 分析HPS时血清中增加的外泌体的分泌细胞对可能导致血清外泌体和外泌体内miR-194增加的细胞进行筛查,并模拟体内条件运用胆汁酸刺激筛查出的细胞,观察其分泌外泌体和miR-194的变化.
7. 在体和离体水平验证肝细胞内P53通路介导的外泌体分泌在HPS血管生成中作用运用P53抑制剂pifithrin-μ、P53 RNAi探讨P53对胆汁酸处理后肝细胞中TASP6表达、培养基里外泌体浓度以及外泌体miR-194含量的影响。CBDL模型大鼠静脉注射pifithrin-μ、GW4869或anta-miR-194,观察其对肺血管生成及存活率的影响。进一步分析了HPS患者和大鼠血清胞外泌体miR-194水平和P(A-a)O2的相关性。
8. 在果蝇卵室内利用活体成像和光遗传学技术,观察Myo-II流动在群体细胞迁移中的具体作用结果:1.成功构建运用胆总管结扎术(CBDL)诱导的HPS大鼠模型,并从外周血清中提取出外泌体,发现肝肺综合征大鼠血清外泌体浓度存在显著改变,PKH-67标记的血清外泌体可以被PMVEC(大鼠肺微血管内皮细胞)吸收。
2. 来源于肝肺综合征大鼠血清的外泌体可以显著促进PMVEC(大鼠肺微血管内皮细胞)的增殖、迁移及成管效应。
3. miRNA生物芯片及qRT-PCR验证结果提示miR-194在肝肺综合征大鼠血清的外泌体内表达显著升高。
4.miR-194可以显著促进PMVEC(大鼠肺微血管内皮细胞)的增殖、迁移及成管效应。
参考文献
[1]Pulmonary transit time derived from pulmonary angiography for the diagnosis of hepatopulmonary syndrome[J].He Zhao;;Jiaywei Tsauo;;Xiaowu Zhang;;Huaiyuan Ma;;Ningna Weng;;Luhua Wang;;Xiao Li.Liver International,2018(11)
[2]Overexpression of STAT1 suppresses angiogenesis under hypoxia by regulating VEGF‑A in human glioma cells[J].Yunsheng Zhang;;Guishan Jin;;Junwen Zhang;;Ruifang Mi;;Yiqiang Zhou;;Wenhua Fan;;Sen Cheng;;Wenjie Song;;Bo Zhang;;Mengjiao Ma;;Fusheng Liu.Biomedicine&Pharmacotherapy,2018
[3]Correlations of MMP-2 and MMP-9 gene polymorphisms with the risk of hepatopulmonary syndrome in cirrhotic patients:A case-control study[J].Jian-Wei Liu;;Dong-Qiong Chen.Kaohsiung Journal of Medical Sciences,2018
[4]aPKC is a key polarity determinant in coordinating the function of three distinct cell polarities during collective migration[J].Heng Wang;;Zhiqian Qiu;;Zehao Xu;;Samuel John Chen;;Jun Luo;;Xiaobo Wang;;Jiong Chen.Development,2018(9)
[5]陈林.肝细胞来源的miR-194激活PMVEC促进血管生成在肝肺综合征中的作用及机制[D].中国人民解放军陆军军医大学,2020.
欢迎您浏览更多关于PMVEC的相关新闻资讯信息